ОЦЕНКА ПРИМЕНЕНИЯ ЛИПОСОМАЛЬНОГО ПЕНТОКСИФИЛЛИНА ПРИ ЦЕРЕБРАЛЬНОЙ ИШЕМИИ У КРЫС В ЭКСПЕРИМЕНТЕ
ОЦЕНКА ПРИМЕНЕНИЯ ЛИПОСОМАЛЬНОГО ПЕНТОКСИФИЛЛИНА ПРИ ЦЕРЕБРАЛЬНОЙ ИШЕМИИ У КРЫС В ЭКСПЕРИМЕНТЕ
Аннотация
Период полувыведения пентоксифиллина после введения составляет 1,6 ч, поэтому особый интерес представляют пролонгированные формы с длительным высвобождением. Цель работы – оценить, может ли липосомальный пентоксифиллин оказывать нейропротекторное действие in vivo при церебральной ишемии. Во время окклюзии средней мозговой артерии у животных в группах №2-4 появлялись патологические ЭЭГ-паттерны. Анализ результатов выявил меньшую площадь инфаркта у животных в группе 4, получавших и\п липосомальный пентоксифиллин, в сравнении с контролем 2. Хотя точный механизм, посредством которого пентоксифиллин оказывает нейропротекторное действие in vivo, неизвестен, в биологических системах экспериментально продемонстрированы эффекты, от взаимодействия с его аденозиновым рецептором.
1. Введение
Пентоксифиллин – производное ксантина. Механизм его действия связан с ингибированием фосфодиэстеразы и накоплением циклического аденозинмонофоефата (цАМФ) в клетках, снижением концентрации внутриклеточного кальция. Пентоксифиллин обладает слабым положительным инотропным эффектом на сердце, улучшает микроциркуляцию в зонах нарушенного кровообращения. Период полувыведения пентоксифиллина после введения составляет 1,6 ч, поэтому особый интерес представляют пролонгированные формы с длительным высвобождением
, .Цель данной работы – оценить, может ли липосомальный пентоксифиллин оказывать нейропротекторное действие in vivo при церебральной ишемии.
2. Методы и принципы исследования
Все манипуляции с животными проводились в соответствии с Руководством по содержанию и использованию лабораторных животных
. Эксперимент проводился на 60 животных (нелинейные белые крысы обоего пола массой 220-335 г.). Все животные находились в стандартных условиях вивария. Животным выполнен (наркоз), включающее интраперитонеальное введение (и/п) препаратов: «Ксилазин» (0,5 мл/кг массы тела) и «Золетил 100» (8мг/кг массы тела) . На аппаратном комплексе «BIOPAC» в соответствии со стандартными методиками производился мониторинг ЭЭГ, ректальной температуры . Животные были разделены на 4 группы: 1-ая группа (контроль 1) (n=15) – ложнооперированные животные, оперативное пособие заключалось в обеспечении доступа к средней мозговой артерии (СМА), при этом окклюзия СМА не производилась. 2-ая группа (контроль 2) (n=15) – инсульт (окклюзия СМА); животным выполнялась 45-минутная окклюзия СМА по методике J. Koizumi , с последующей реперфузией. 3-ью группа (контроль 3) (n=15) – инсульт (окклюзия СМА); животным выполнялась 45-минутная окклюзия СМА по методике J. Koizumi, с последующей реперфузией+пентоксифиллин (ПТХ) и\п 10 (мг\кг) за 1 минуту до реперфузии; 4-ая группа (n=15) – инсульт (окклюзия СМА); животным выполнялась 45-минутная окклюзия СМА по методике J. Koizumi, с последующей реперфузией+ липосомальный пентоксифиллин и\п 10 мг\кг за 1 минуту до реперфузии. Липосомальные формы были получены из лецитина (500 мг) и холестерина (5 мг) методикой обращения фаз. Инкапсуляция пентоксифиллина выполнена пассивной загрузкой. Раствор пентоксифиллина 100 мг (5 мл) медленно вливали в мерную колбу объёмом 50 мл, добавляли трисаминометан 3,5 мл с последующим постепенным нагревом на ультразвуковой водяной бане до 40°С, затем вливали деионизированную воду до 50 мл, перемешивали в течение 45 минут. На следующем этапе лецитин (500 мг) и холестерин (5 мг) помещали в колбу, добавляли хлороформ. Хлороформ выпаривался, при центрифугировании и постепенном увеличении количества оборотов со 100 об/мин до 1700 об/мин. Проводилось высушивание, и образование липидной плёнки. После чего её гидратировали 5-ю мл раствора пентоксифиллина. Полученную дисперсию подвергали экструдированию, для фильтрации применяли диализный фильтр с диаметром пор 100 нм. Размер липосом был определен на наносайзере NANO-flex, с автоматическим подсчетом при помощи программного комплекса Microtrac Flex 11.0.0.2. Распределение, полученных липосом по диаметру (nm) получили следующее: 80,5 nm – 100%. На 3 сутки часть животных выводилась из эксперимента путем эвтаназии. Полученный биоматериал (головной мозг) фиксировали в 10% растворе формалина, осуществлялось иссечение биоматериала, заливка в парафин, приготовление срезов, с последующим окрашиванием гематоксилином и эозином по стандартной методике. На следующем этапе происходила оценка области инфаркта с подсчетом в % (оценка области инфаркта происходила после отцифровки микрофографий в программной среде Windows 10 c использованием стандартного графического редактора). Для статистической обработки был применен t-критерия Стьюдента и критерий Манна-Уитни. Результаты представлены следующим образом, М ± m (М – среднее, m – ошибка среднего). Данные принимались за статистически значимые при р<0,05.3. Результаты и их обсуждение
Во время окклюзии СМА у животных в группах №2-4 появлялись патологические ЭЭГ-паттерны (вспышка-подавление и паттерны распада). С момента окклюзии СМА у животных в группах № 2- 4 фиксировалось плавное угасание суммарной альфа и бетта –активности, с последующей дезорганизацией и исчезновением альфа-активности. Снижение суммарной амплитуды и полное угасание потенциалов регистрировалось в группах животных №2-4 на 17,4±4,65 секунде с момента окклюзии СМА, статистически значимые различия между данными группами не выявлены. В период реперфузии, отмечено возобновление биоэлектрической активности, начинающееся с восстановления альфа-активности и фокального восстановления тета-активности, и суммарным повышением амплитуды потенциалов. Наиболее обширный инфаркт головного мозга отмечен у животных в группе №2 – локализованный преимущественно в неокортексе, с коагуляционным некрозом, вовлекающим лобные и теменные области коры (рис.1).
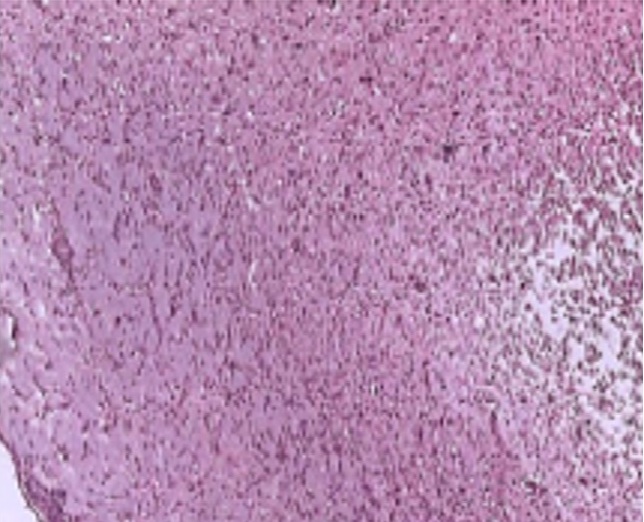
Рисунок 1 - Пример деструкции вещества мозга с диффузной лейкоцитарной инфильтрацией в области инфаркта головного мозга у крыс в контрольной группе
Примечание: группа №2; окр. гематоксилином и эозином, ув. х100
Хотя точный механизм, посредством которого пентоксифиллин оказывает нейропротекторное действие in vivo, неизвестен, в биологических системах экспериментально продемонстрированы эффекты, которые могут привести к защите от ишемического повреждения головного мозга, возможно, они связаны с механизмом его аденозинового рецептора, связанного с G-белком A2BAR (GPCR)
, . Прямое воздействие пентоксифиллина и его метаболитов на окислительно-восстановительные процессы, уменьшают NMDA-опосредованный приток кальция, in vivo это, вероятно, приводит к уменьшению размера инфаркта.Роль оксида азота в нейротоксичности, опосредованной рецептором NMDA, остается спорной
, . Если оксид азота действительно играет важную роль, пентоксифиллин и его метаболиты могут быть важны в его метаболизме , , учитывая эффективность, как нейтрализатора супероксида с образованием пероксинитрита. Токсичность пероксинитрита и эффективность ПТХ и его метаболитов в удалении супероксида, позволяет предположить, что ингибирование образования пероксинитрита может быть дополнительным механизмом нейропротекции. Экспериментально, острая ишемия, сопровождаемая реперфузией, связана с повышением и последующей депрессией восстановленного никотинамидадениндинуклеотида. Таким образом, окислительно-восстановительная активность ПТХ может приводить к удалению или образованию супероксида, и к взаимодействию в окислительно-восстановительных реакциях в зависимости от молекулярно-рецепторного окружения во время ишемии и реперфузии.4. Заключение
В данном исследовании мы оценили, может ли липосомальный пентоксифиллин оказывать нейропротекторное действие in vivo при церебральной ишемии. Во время окклюзии СМА у животных в группах №2-4 появлялись патологические ЭЭГ-паттерны (вспышка-подавление и паттерны распада). Поскольку краниальная и ректальная температура у животных, получавших липосомальный пентоксифиллин, не отличалась от групп № 1-3, маловероятно, что нейропротекторный эффект опосредован изменениями температуры во время ишемии. Таким образом, можно предположить, что и\п введение липосомального пентоксифиллина в дозе 10 мг\кг оказывает нейропротективное действие у выживших животных. Поскольку липосомальный пентоксифиллин оказался перспектиным соединением, весьма целесообразным является проведение дальнейших исследований, включающей оценку неврологического дефицита в отдаленной перспективе и выявление других вероятных эффектов данного соединения.
